Supervisión del Flujo Sanguíneo Cerebral
![]()
PSI para la supervisión del flujo sanguíneo cerebral
La exclusiva combinación de elevada resolución espacial, amplio campo de visión y alta tasa de fotogramas convierte a PeriCam PSI en el instrumento ideal para obtener imágenes cerebrales de gran calidad y supervisar los cambios rápidos.
Los cambios en el flujo sanguíneo cerebral (FSC) son característicos de un gran número de trastornos neurológicos y, por tanto, constituyen el centro de atención de muchos estudios en el ámbito de las neurociencias. Para realizar estos estudios es necesario disponer de herramientas que permitan investigar los cambios, preferiblemente mediante métodos no invasivos en tiempo real. El sistema PeriCam PSI es un generador de imágenes de perfusión sanguínea que se basa en la tecnología de análisis de contraste de moteado láser (LASCA, por sus siglas en inglés). Con LASCA, ahora se puede estudiar la microcirculación de formas que no eran posibles en el pasado. Permite la visualización en tiempo real de la perfusión sanguínea tisular y combina la respuesta dinámica con la resolución espacial. No tiene influencia sobre la perfusión, ya que no se necesita un contacto directo con el tejido; tampoco colorantes de contraste ni elementos marcadores. Para mejorar aún más la capacidad de uso se ha desarrollado un software específico para la aplicación, llamado PIMSoft. El sistema PSI se ha utilizado ampliamente para supervisar el FSC y los cambios en el mismo en diversos modelos murinos con el fin de describir las características anatomopatológicas de las enfermedades y supervisar la eficacia de los tratamientos.
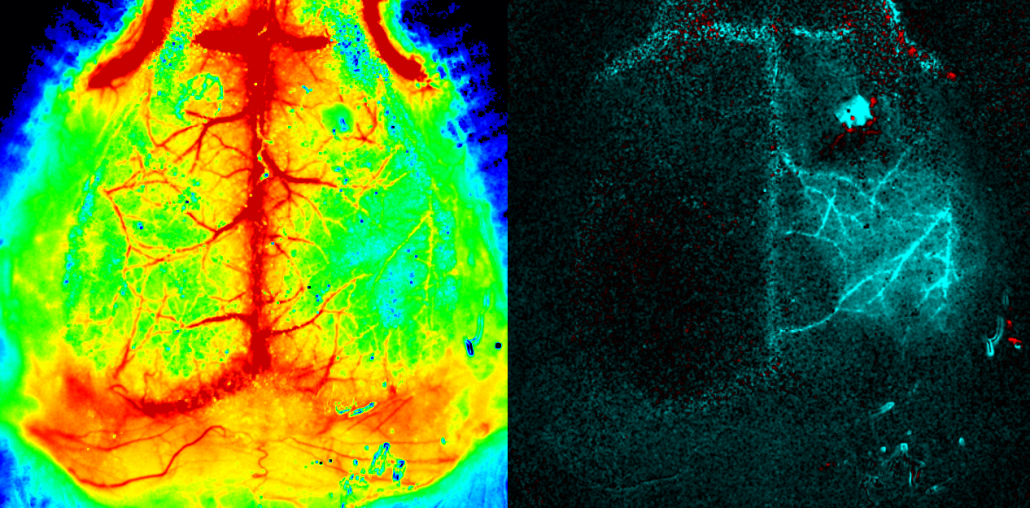
Cerebro de ratón. PeriCam PSI HR (alta resolución) Por cortesía del Dr. Offenhauser, Charité, Berlín, Alemania.
Aspectos generales
PeriCam PSI ha demostrado ser una herramienta muy útil en diversos campos dentro del sector de la investigación del flujo sanguíneo
cerebral. Entre estos campos, uno de los principales es la investigación de las lesiones cerebrales isquémicas. Tanto los accidentes cerebrovasculares isquémicos como los hemorrágicos pueden provocarse, y el alcance de los mismos puede determinarse empleando PeriCam PSI. Asimismo, se puede realizar un seguimiento del proceso dinámico tras el accidente cerebrovascular a lo largo del tiempo. Los modelos de hipoperfusión cerebral crónica y lesiones cerebrales traumáticas también pueden analizarse con PeriCam PSI.
Otro campo es el estudio de los cambios hemodinámicos cerebrales, en el que la combinación de elevada resolución espacial, amplio campo de visión y alta tasa de fotogramas convierte a PeriCam PSI en una herramienta idónea para analizar los cambios rápidos en el FSC. La técnica resulta ideal para visualizar las ondas del cambio de perfusión que se producen en la despolarización cortical extendida, y el modo de imágenes de diferencias se desarrolló pensando en esta aplicación. Más recientemente, el acoplamiento neurovascular ha resultado ser una aplicación adecuada para esta técnica.
PSI para la caracterización de las lesiones cerebrales isquémicas
Sus exclusivas características hacen que PSI resulte adecuado para el estudio de las lesiones cerebrales isquémicas en varios modelos, incluidos los de accidentes cerebrovasculares, hipoperfusión cerebral crónica y lesiones cerebrales traumáticas.
Amplio campo de visión: La visualización de una zona completa del cerebro permite confirmar y caracterizar las lesiones isquémicas
Elevada resolución espacial: Ofrece una localización precisa de las lesiones. La inserción de regiones de interés (ROI) permite medir la zona de la lesión y puede utilizarse para realizar un seguimiento de la recuperación de la lesión.
Función de reanudación del registro: Simplifica la toma y el análisis de datos en estudios longitudinales mediante el registro de mediciones repetidas del mismo sujeto en un solo archivo, pudiéndose comparar con facilidad las mismas ROI a lo largo del tiempo.
Accidentes cerebrovasculares
o Modelo de oclusión de la arteria cerebral media (MCAO, por sus siglas en inglés): Se inserta un filamento en la arteria para ocluir el flujo de sangre durante un periodo de tiempo determinado (normalmente, de entre 30 y 120 minutos) antes de su retirada para la reperfusión, que provoca un accidente cerebrovascular isquémico 1-9.
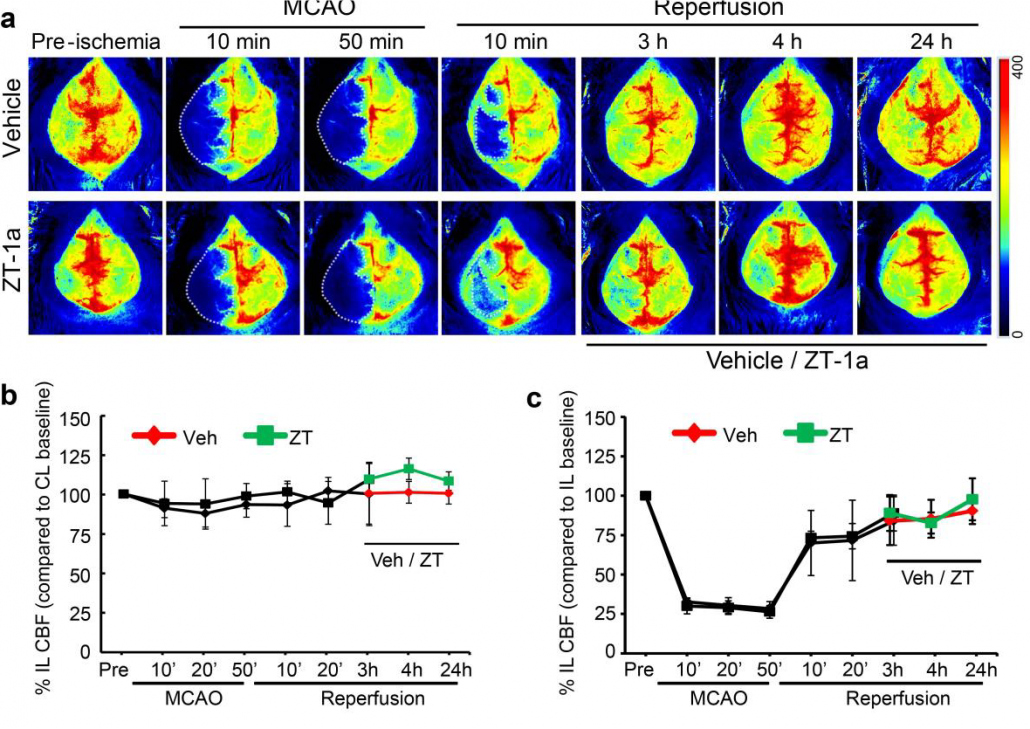
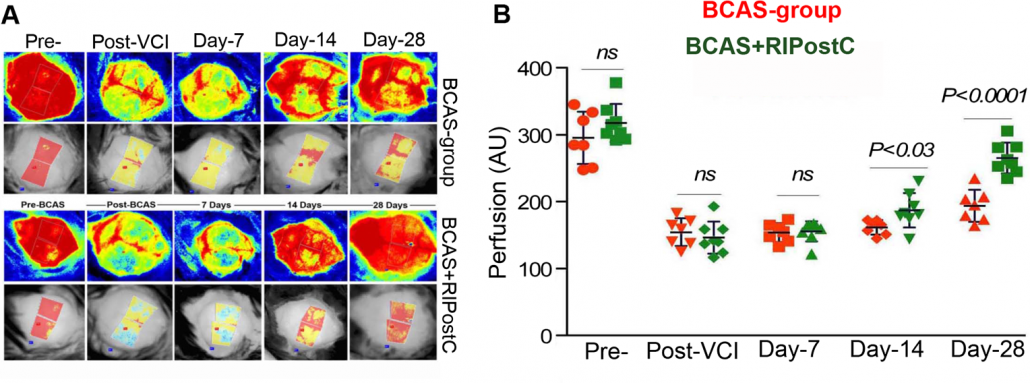
Imágenes de perfusión en cerebro de ratón antes, durante y después de la MCAO, junto con los cambios cuantificados en la perfusión sanguínea en los lados ispsilaterales y contralaterales, tanto en animales tratados como no tratados.
Por cortesía de Dandan Sun e Iqbal H. Bhuiyan, Departamento de Neurología e Instituto de Enfermedades Neurodegenerativas de Pittsburgh, Universidad de Pittsburgh. Figura reproducida con el permiso de Nature Communications, publicada originalmente en: Zhang, J., Bhuiyan, M.I.H., Zhang, T. et al. Modulation of brain cation-Cl− cotransport via the SPAK kinase inhibitor ZT-1a. Nat Commun 11, 78 (2020). doi: 10.1038/s41467-019-13851-6
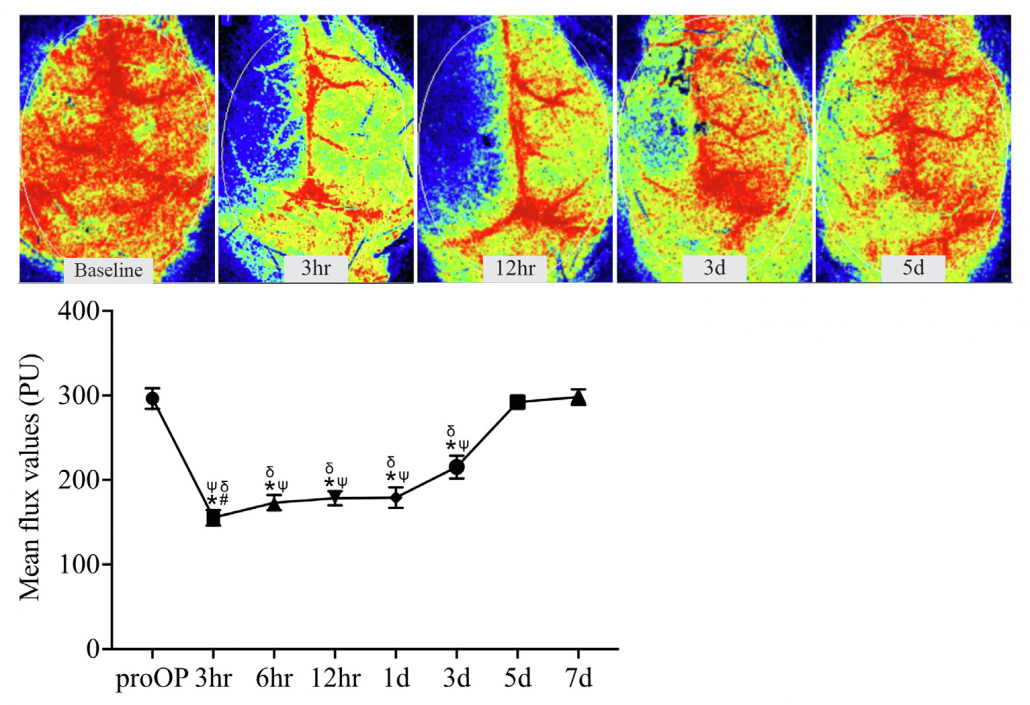
o Modelo de hemorragias subaracnoideas (HSA): Se inserta un filamento con el fin de perforar la arteria cerebral anterior, lo que da lugar a un accidente cerebrovascular 10-13.
 Brain Research 1727 (2020) 146566
Brain Research 1727 (2020) 146566
Imágenes de perfusión en cerebro de ratón antes y después de una lesión por HSA. Se realizó un seguimiento del mismo animal durante la semana posterior a la lesión para evaluar la recuperación. Imágenes obtenidas con PSI HR.
Hipoperfusión cerebral crónica
o Modelo de oclusión bilateral de la arteria carótida común (BCCAO, por sus siglas en inglés): Las arterias carótidas comunes se unen doblemente con firmeza mediante suturas o microespirales para crear regiones isquémicas en ambos hemisferios 14-20.
Imágenes de perfusión en cerebro de ratón antes, durante y después de la lesión por BCCAO, junto con los cambios cuantificados en la perfusión sanguínea tanto en animales tratados como no tratados. Los animales se sometieron a seguimiento durante el mes posterior a la lesión.
Por cortesía del Dr. Nasrul Hoda Universidad de Georgia Regents, Universidad de Georgia, y Centro Médico para Exmilitares Charlie Norwood, Augusta, Georgia.
Figura reproducida con el permiso de Translational Stroke Research y publicada originalmente en: Khan, M.B., Hoda, M.N., Vaibhav, K. et al. Remote Ischemic Postconditioning: Harnessing Endogenous Protection in a Murine Model of Vascular Cognitive Impairment. Transl. Stroke Res. 6, 69-77 (2015). https://doi.org/10.1007/s12975-014-0374-6.
Lesiones cerebrales traumáticas
o Modelo de impacto cortical controlado (CCI, por sus siglas en inglés): Dispositivo de contusión que se usa para provocar lesiones controladas en la corteza sensitivomotora 21-23.
o Modelo de caída de un peso/aceleración con impacto: Se deja caer un peso sobre el cráneo desprotegido para provocar una lesión cerebral.
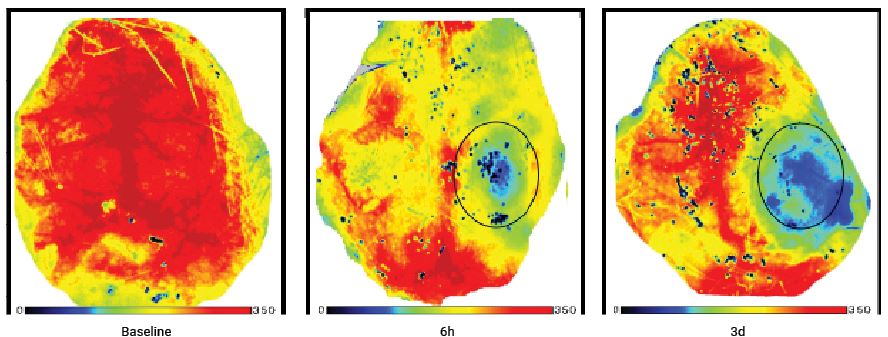
Imágenes de perfusión de cerebro de ratón antes y después de una lesión cerebral traumática. Se realizó un seguimiento del mismo animal durante los 3 días posteriores a la lesión.
Por cortesía del Dr. Han Liu Departamento de Neurocirugía, Primer Hospital Asociado de la Universidad Médica de Chongqing, Chongqing 400016, República Popular China
H. Liu et al./Brain Research 1700 (2018) 118-125
PSI para la caracterización de los cambios hemodinámicos cerebrales
Sus exclusivas características hacen que PSI resulte adecuado para estudiar los pequeños cambios dinámicos en el FSC como respuesta a la estimulación, ya que permite visualizar los cambios en la perfusión en el espacio y el tiempo. Las respuestas anómalas son signos tempranos que indican la existencia de una disfunción cognitiva.
La tasa de fotogramas y la resolución espacial elevadas permiten registrar los cambios dinámicos en la microvasculatura cerebral en pequeñas estructuras como consecuencia de estímulos externos.
Las imágenes de diferencias ofrecen una mejor visualización de los cambios sutiles en el FSC.
Acoplamiento neurovascular (NVC)
Mecanismo homeostático esencial que garantiza un ajuste adecuado del FSC a los aumentos en la demanda de oxígeno y nutrientes de las neuronas activadas, produciendo una hiperemia funcional. El NVC (acoplamiento neurovascular, por sus siglas en inglés) desempeña un papel fundamental a la hora de mantener una función cognitiva saludable. PSI se utiliza para registrar los cambios hemodinámicos en la corteza somatosensitiva como respuesta a la estimulación eléctrica aplicada al nervio ciático 24 o la estimulación de las vibrisas 25-28. La alteración del NVC contribuye al deterioro cognitivo asociado a la edad.
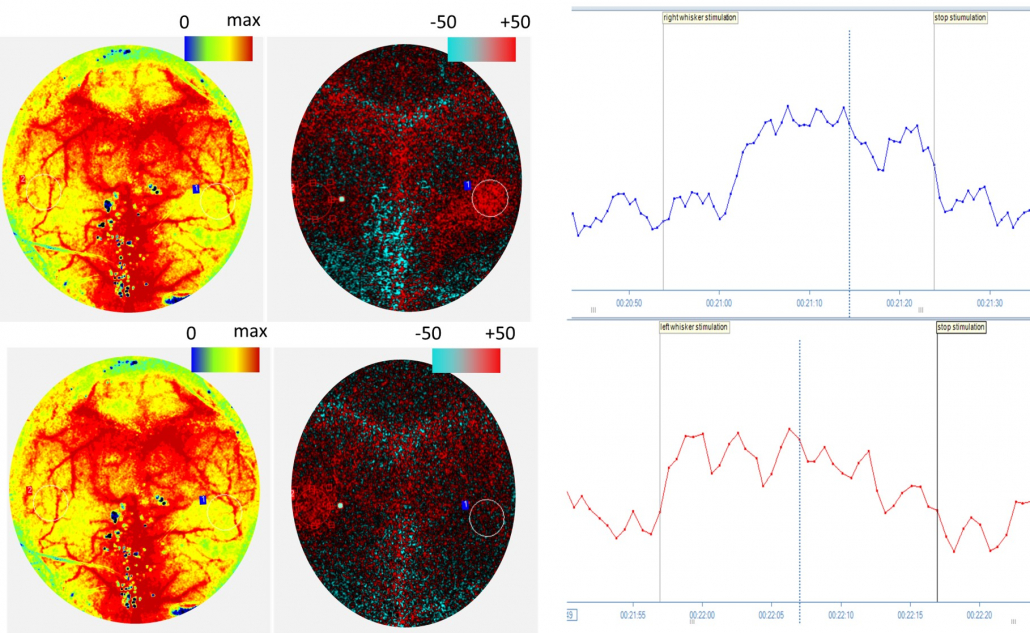
Imágenes de perfusión cerebral en ratones que se muestran en forma de imágenes absolutas y de diferencias durante una estimulación de las vibrisas de 30 segundos en las vibrisas de la derecha (arriba) y la izquierda (abajo). Datos gráficos de PIMSoft de ROI en la corteza de barriles durante una estimulación en la que se espera que se produzca un aumento de la perfusión. Los resultados de disfunción cognitiva en una reducción de la perfusión aumentan debido a la estimulación.
Por cortesía del Dr. Stefano Tarantini y el Dr. Zoltan Ungvari del Centro de Ciencias de la Salud de la Universidad de Oklahoma, Oklahoma City, Oklahoma.
Despolarización cortical extendida (CSD)
Ondas de despolarización súbita y casi completa de los gradientes de iones transmembrana neuronales que provocan edema citotóxico y se propagan a unos 3 mm/min en la sustancia gris del cerebro, dando lugar a la propagación de la isquemia. La CSD juega un papel fundamental en la neurodegeneración tras las lesiones cerebrales agudas. PSI se utiliza para registrar los cambios hemodinámicos debidos a la punción con agujas o la aplicación tópica de una solución de potasio muy concentrada 29-32.
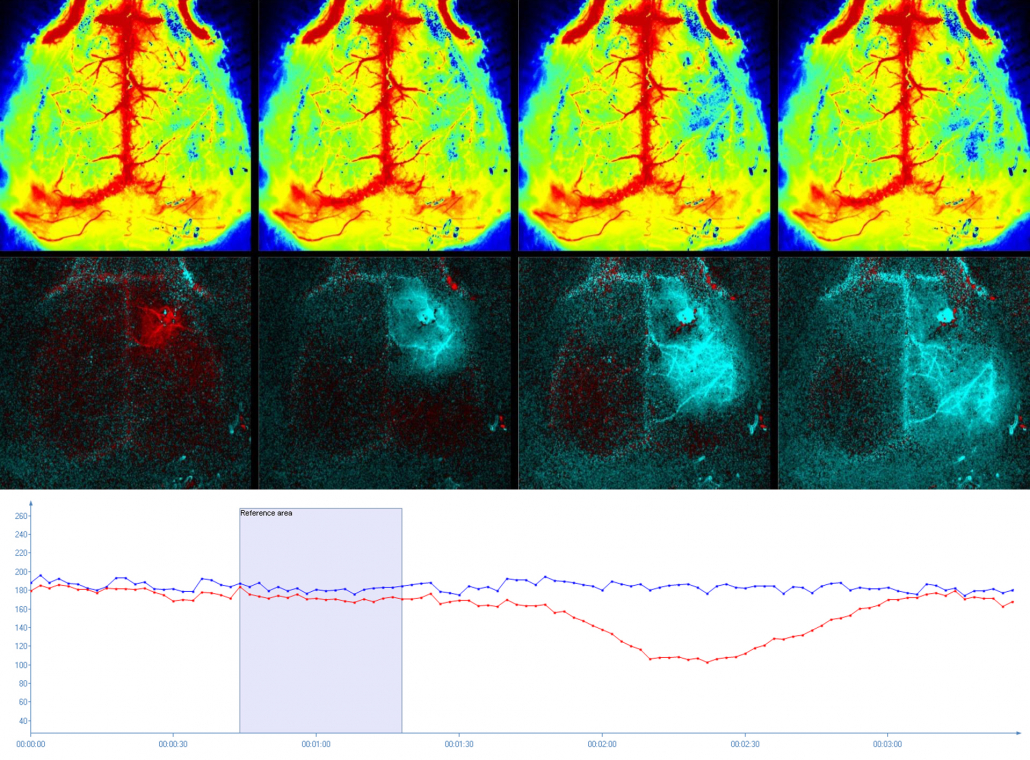
Imágenes de despolarización extendida en cerebro de ratón obtenidas con PeriCam PSI HR. Se puede visualizar y cuantificar (gráfico) la perfusión absoluta (fila superior) y, con el modo de imágenes de diferencias especialmente desarrollado a tal efecto (fila inferior), se puede realizar un seguimiento espectacular del cambio en la perfusión provocado por la onda de SD. Por cortesía de Charité, Berlín, Alemania.
Bibliografía:
1. Morroniside promotes angiogenesis and further improves microvascular circulation after focal cerebral ischemia/reperfusion. T. Liu, B. Xiang, D. Guo, F. Sun, Re. Wei, G. Zhang, H. Aia, X.Tian, Z. Zhu, W. Zheng, Y. Wanga W.Wang. 2016, Brain Res Bull. , pp. 111-118.
2. C‐C Chemokine Receptor Type 5 (CCR5)‐Mediated Docking of Transferred Tregs Protects Against Early Blood‐Brain Barrier Disruption After Stroke. Peiying Li, Long Wang, Yuxi Zhou, Yu Gan, Wen Zhu, Yuguo Xia, Xiaoyan Jiang, Simon Watkins, Alberto Vazquez, Angus W. Thomson, Jun Chen, Weifeng Yu, Xiaoming Hu. 2017, Journal of the American Heart Association, p. e006387.
3. Endothelium-targeted overexpression of heat shock protein 27 ameliorates blood–brain barrier disruption after ischemic brain injury. Yejie Shi, Xiaoyan Jiang, Lili Zhang, Hongjian Pu, Xiaoming Hu, Wenting Zhang, Wei Cai, Yanqin Gao, Rehana K. Leak, Richard F. Keep, Michael V. L. Bennett, and Jun Chen. 2017, PNAS, Proceedings of the National Academy of Sciences, pp. E1243-E1252.
4. Brain ischemic preconditioning protects against ischemic injury and preserves the blood-brain barrier via oxidative signaling and Nrf2 activation. Tuo Yang, Yang Sun, Leilei Mao, Meijuan Zhang, Qianqian Li, Lili Zhang, Yejie Shi, Rehana K. Leak, Jun Chen, Feng Zhang. 2017, Redox Biology, pp. 323-337.
5. Brain-Derived Glia Maturation Factor β Participates in Lung Injury Induced by Acute Cerebral Ischemia by Increasing ROS in Endothelial Cells. Fei-Fei Xu, Zi-Bin Zhang, Yang-Yang Wang & Ting-Hua Wang. 2018, Neuroscience Bulletin, pp. 1077-1090.
6. The microRNA miR-7a-5p Ameliorates Ischemic Brain Damage by Repressing α-Synuclein. Kim T, Mehta SL, Morris-Blanco KC, Chokkalla AK, Chelluboina B, Lopez M, Sullivan R, Kim HT, Cook TD, Kim JY, Kim H, Kim C, Vemuganti R. 2018, Science Signaling, p. eaat4285.
7. Assessing the effects of Ang-(1-7) therapy following transient middle cerebral artery occlusion. M. M. C. Arroja, E. Reid, L. A. Roy, A. V. Vallatos, W. M. Holmes, S. A. Nicklin, L. M. Work & C. McCabe. 2019, Scientific Reports, p. 3154.
8. Modulation of brain cation-Cl− cotransport via the SPAK kinase inhibitor ZT-1a. Jinwei Zhang, Mohammad Iqbal H. Bhuiyan, Ting Zhang, Jason K. Karimy, Zhijuan Wu, Victoria M. Fiesler, Jingfang Zhang, Huachen Huang, Md Nabiul Hasan, Anna E. Skrzypiec, Mariusz Mucha, Daniel Duran, Wei Huang, Robert Pawlak, Lesley M. Foley, T. Kevin Hitc. 2020, Nature Communications.
9. Endothelium-targeted deletion of the miR-15a/16-1 cluster ameliorates blood-brain barrier dysfunction in ischemic stroke. Feifei Ma, Ping Sun, Xuejing Zhang, Milton H. Hamblin, and Ke-Jie Yin. 2020, Science Signaling.
10. Early Changes of Brain Perfusion After Subarachnoid Hemorrhage – the Effect of Sodium Nitroprusside. M Kolar, K Nohejlova, J Mares, J Pachl. 2016, Physiological Research, pp. S591-S599.
11. Changes of Cortical Perfusion in the Early Phase of Subarachnoid Bleeding in a Rat Model and the Role of Intracranial Hypertension. M Kolar, K Nohejlova, F Duska, J Mares, J Pachl. 2017, Physiological Research, pp. S545-S551.
12. Neuroprotective Effects of Nasopharyngeal Perfluorochemical Cooling in a Rat Model of Subarachnoid Hemorrhage. Mustafa Yavuz Samanci, Gennaro Calendo, Sandy T. Baker, Kadir Erkmen, Michael W. Weaver, Marla R. Wolfson. 2019, World Neurosurgery, pp. e481-e492.
13. Tauroursodeoxycholic acid prevents ER stress-induced apoptosis and improves cerebral and vascular function in mice subjected to subarachnoid hemorrhage. Xin Chen, Jianhao Wang, Xiangliang Gao, Ye Wu, Gang Gu, Mingming Shi, Yan Chai, Shuyuan Yue, Jianning Zhang. 2020, Brain Research, p. 146566.
14. TREM-2-p38 MAPK signaling regulates neuroinflammation during chronic cerebral hypoperfusion combined with diabetes mellitus. Jiawei Zhang, Yu Liu, Yaling Zheng, Yan Luo, Yu Du, Yao Zhao, Jian Guan, Xiaojie Zhang & Jianliang Fu. 2020, Journal of Neuroinflammation, Vol. 17.
15. Chronic Remote Ischemic Conditioning Is Cerebroprotective and Induces Vascular Remodeling in a VCID Model. Mohammad Badruzzaman Khan, Sherif Hafez, Md. Nasrul Hoda, Babak Baban, Jesse Wagner, Mohamed E. Awad, Hasith Sangabathula, Stephen Haigh, Mohammed Elsalanty, Jennifer L. Waller, David C. Hess. 1, 2018, Translational Stroke Research, Vol. 9, pp. 51-63.
16. Astroglial NF-kB contributes to white matter damage and cognitive impairment in a mouse model of vascular dementia. Raman Saggu, Toni Schumacher, Florian Gerich, Cordula Rakers, Khalid Tai, Andrea Delekate and Gabor C. Petzold. 4, 2016, Acta Neuropathologica Communications, Vol. 76.
17. Astrocyte-derived lipocalin-2 mediates hippocampal damage and cognitive deficits in experimental models of vascular dementia. Suk, Jae‐Hong Kim Pan‐Woo Ko Ho‐Won Lee Ji‐Young Jeong Maan‐Gee Lee Jong‐Heon Kim Won‐Ha Lee Ri Yu Won‐Jong Oh Kyoungho. 2017, Glia, pp. 1-20.
18. Cerebral microvascular dysfunction in metabolic syndrome is exacerbated by ischemia–reperfusion injury. Nathalie Obadia, Marcos Adriano Lessa, Anissa Daliry, Raquel Rangel Silvares, Fabiana Gomes, Eduardo Tibiriçá & Vanessa Estato. 67, 2017, BMC Neuroscience, Vol. 18.
19. The impact of early aerobic exercise on brain microvascular alterations induced by cerebral hypoperfusion. Marina Leardini-Tristão, Juliana Pereira Borges, Felipe Freitas, Raquel Rangel, Anissa Daliry,. 2017, Brain Research, Vol. 1657, pp. 43-51.
20. The Role of Autophagy in the Correlation Between Neuron Damage and Cognitive Impairment in Rat Chronic Cerebral Hypoperfusion. Wenying Zou, Yufei Song, Yumei Li, Yu Du, Xiaojie Zhang, Jianliang Fu. 1, 2018, Molecular Neurobiology, Vol. 55, pp. 776-791.
21. Clinical and Basic Evaluation of the Prognostic Value of Uric Acid in Traumatic Brain Injury. Liu H, He J, Zhong J, Zhang H, Zhang Z, Liu L, Huang Z, Wu Y, Jiang L, Guo Z, Xu R, Chai W, Huo G, Sun X, Cheng C. 10, 2018, International Journal of Medical Sciences, Vol. 15, pp. 1072-1082.
22. Selective activation of cannabinoid receptor-2 reduces neuroinflammation after traumatic brain injury via alternative macrophage polarization. Molly Braun, Zenab T.Khan, Mohammad B.Khan, Manish Kumar, Ayobami Ward, Bhagelu R.Achyut, Ali S.Arbab, David C.Hess, Md. Nasrul Hoda, Babak Baban, Krishnan M.Dhandapani, Kumar Vaibhav. 2018, Brain, Behavior, and Immunity, Vol. 68, pp. 224-237.
23. Evolution of cerebral perfusion in the peri-contusional cortex in mice revealed by in vivo laser speckle imaging after traumatic brain injury. Han Liu, Junchi He, Zhaosi Zhang, Liu Liu, Gang Huo, Xiaochuan Sun, Chongjie Cheng. 2018, Brain Research, Vol. 1700, pp. 118-125.
24. Regulation of cortical blood flow responses by the nucleus basalis of Meynert during nociceptive processing. Thierry Paquette, Ryota Tokunaga, Sara Touj, Hugues Leblond, Mathieu Piché. 149, 2019, Neuroscience Research, pp. 22-28.
25. Demonstration of impaired neurovascular coupling responses in TG2576 mouse model of Alzheimer’s disease using functional laser speckle contrast imaging. Stefano Tarantini, Gabor A. Fulop, Tamas Kiss, Eszter Farkas, Dániel Zölei-Szénási, Veronica Galvan, Peter Toth, Anna Csiszar, Zoltan Ungvari, Andriy Yabluchanskiy. 4, 2017, GeroScience, Vol. 39, pp. 465-473.
26. Overexpression of catalase targeted to mitochondria improves neurovascular coupling responses in aged mice. Anna Csiszar, Andriy Yabluchanskiy, Anna Ungvari, Zoltan Ungvari & Stefano Tarantini. 5, 2019, GeroScience, Vol. 41, pp. 609-617.
27. Pharmacological or genetic depletion of senescent astrocytes prevents whole brain irradiation–induced impairment of neurovascular coupling responses protecting cognitive function in mice. Andriy Yabluchanskiy, Stefano Tarantini, Priya Balasubramanian, Tamas Kiss, Tamas Csipo, Gábor A. Fülöp, Agnes Lipecz, Chetan Ahire, Jordan DelFavero, Adam Nyul-Toth, William E. Sonntag, Michal L. Schwartzman, Judith Campisi, Anna Csiszar & Zoltan Ungvari. 2020, GeroScience.
28. Treatment with the mitochondrial-targeted antioxidant peptide SS-31 rescues neurovascular coupling responses and cerebrovascular endothelial function and improves cognition in aged mice. Stefano Tarantini, Noa M. Valcarcel-Ares, Andriy Yabluchanskiy, Gabor A. Fulop, Peter Hertelendy, Tripti Gautam, Eszter Farkas, Aleksandra Perz, Peter S. Rabinovitch, William E. Sonntag, Anna Csiszar, Zoltan Ungvari. 2, 2018, Aging Cell, Vol. 17, p. e12731.
29. The antagonism of prostaglandin FP receptors inhibits the evolution of spreading depolarization in an experimental model of global forebrain ischemia. Dániel P. Varga, Írisz Szabó, Viktória É. Varga, Ákos Menhyárt, Orsolya M. Tóth, Mihály Kozma, Armand R. Bálint, István A. Krizbai, Ferenc Bari, Eszter Farkas. 2020, Neurobiology of Disease, Vol. 137, p. 104780.
30. Na+/K+-ATPase α isoform deficiency results in distinct spreading depolarization phenotypes. Clemens Reiffurth, Mesbah Alam, Mahdi Zahedi-Khorasani, Sebastian Major and Jens P Dreier. 3, 2019, Journal of Cerebral Blood Flow & Metabolism, Vol. 40, pp. 622-638.
31. Systemic administration of l-kynurenine sulfate induces cerebral hypoperfusion transients in adult C57Bl/6 mice. Dániel Péter Varga, Ákos Menyhárt, Tamás Puskás, Ferenc Bari, Eszter Farkas, Zsolt Kis, László Vécsei, József Toldi, Levente Gellért. 2017, Microvascular Research, Vol. 114, pp. 19-25.
32. Ansari MZ, Kang EJ, Manole MD, Dreier JP, Humeau-Heurtier A. Monitoring microvascular perfusion variations with laser speckle contrast imaging using a view-based temporal template method. s.l. : Microvascular Research, 2017. pp. 49-59. Vol. 111.
Complete el formulario para obtener más información
Aviso legal: Es posible que los productos que aparecen en el sitio web de Perimed no cuenten con autorización para la venta en todos los mercados.